合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
-
> 不同質量濃度、pH、鹽度對三七根提取物水溶液表面張力的影響(二)
> 粉末涂料的涂裝成膜時,與表面張力有何關系?
> 含氟表面活性劑的合成與應用研究
> 低總濃度下實現"超低界面張力"與"高黏彈性乳狀液"的雙重突破
> 無機鹽濃度對HPAM不同復配體系降低界面張力能力的影響(一)
> 不同濃度下白糖、紅糖溶液的表面張力系數變化
> 不同水淹程度的油藏環境下微生物提高采收率、采出液的表面張力與界面張力的變化(一)
> 不同干燥方式對蛋清蛋白功能特性、溶解度、接觸角、表面張力的影響(二)
> NaOL、HZ組合捕收劑對鋰輝石礦物浮選效果、表面張力影響(一)
> 納米滲吸驅油劑種類、降低界面張力和改變潤濕性的能力等機理研究(三)
推薦新聞Info
-
> 基于粒徑、速度、表面張力、黏度測定揭示塵粒?霧滴碰撞行為規律(三)
> 基于粒徑、速度、表面張力、黏度測定揭示塵粒?霧滴碰撞行為規律(二)
> 基于粒徑、速度、表面張力、黏度測定揭示塵粒?霧滴碰撞行為規律(一)
> 高鹽低滲油藏中超低界面張力表面活性劑多段塞調驅機理與應用效果(三)
> 高鹽低滲油藏中超低界面張力表面活性劑多段塞調驅機理與應用效果(二)
> 高鹽低滲油藏中超低界面張力表面活性劑多段塞調驅機理與應用效果(一)
> 鈉鉀離子濃度對礦井水和純水表面張力、噴霧霧化特性的影響(三)
> 鈉鉀離子濃度對礦井水和純水表面張力、噴霧霧化特性的影響(二)
> 鈉鉀離子濃度對礦井水和純水表面張力、噴霧霧化特性的影響(一)
> Layzer模型與Zufiria模型研究界面張力對Rayleigh-Taylor氣泡不穩定性的影響
牡蠣低分子肽LOPs雙重乳液制備、界面性質檢測及消化吸收特性研究(二)
來源:食品科學技術學報 瀏覽 529 次 發布時間:2025-07-04
1.3實驗方法
1.3.1 LOPs的制備
新鮮牡蠣開殼后取出全肉,牡蠣肉與水按照料液比為1∶3(g:mL)進行勻漿處理,8 000 r/min勻漿2 min,按3 300 U/g加入動物蛋白酶,47℃下酶解3 h,酶解后于95℃滅酶10 min,于4 500 r/min離心20 min,收集上清液。用超濾膜過濾上清液,將濾液濃縮處理后進行噴霧干燥,即可獲得LOPs。
1.3.2 LOPs界面性質檢測
1.3.2.1 LOPs濕潤性測定
采用全自動界面黏彈性測量儀測定LOPs的三相接觸角θ,將LOPs薄片(厚度為1 mm、直徑為10 mm)置于載物臺后(環境為氣相),向下緩慢移動針管(懸掛8μL的液滴)使得液滴(液相)轉移至薄片(固相),利用系統攝像機拍攝記錄圖像。在每個片劑表面的不同位置進行測量,測量結果取平均值。
1.3.2.2 LOPs水溶液界面張力測定
池內,形成18μL的LOPs液滴浸沒于大豆油中,懸掛時間為600 s。在室溫(25℃)下,使用儀器自帶軟件分析液滴輪廓,并監測液滴形狀的動態變化,根據楊氏方程(Laplace-Young)擬合結果計算液滴的界面張力。
1.3.3 LOPs雙重乳液制備及體外模擬消化吸收特性測定
1.3.3.1 LOPs的W1/O/W2型雙重乳液制備
通過兩步法制備雙重乳液,制備流程及分子模型見圖1。操作步驟:將內、外水相及油相攪拌15 min,混勻后于4℃避光貯藏12 h備用;第一步,將質量分數為20%的LOPs水溶液作內水相,內水相與油相的質量比為4∶6。將內水相加入含有PGPR(質量分數為5%)的大豆油中,先經高速剪切機(12 000 r/min,2 min)混合后,再經高壓均質機在70 MPa條件下循環3次,獲得W1/O初乳液。第二步,將質量分數為0.8%的吐溫80水溶液作外水相,W1/O乳液與外水相的質量比為5∶5。將W1/O乳液加入外水相后,再用高速剪切機(4 000 r/min,1 min)混合,并經高壓均質機在30 MPa的條件下均質1次,獲得LOPs的W1/O/W2型雙重乳液,于4℃條件下存儲。
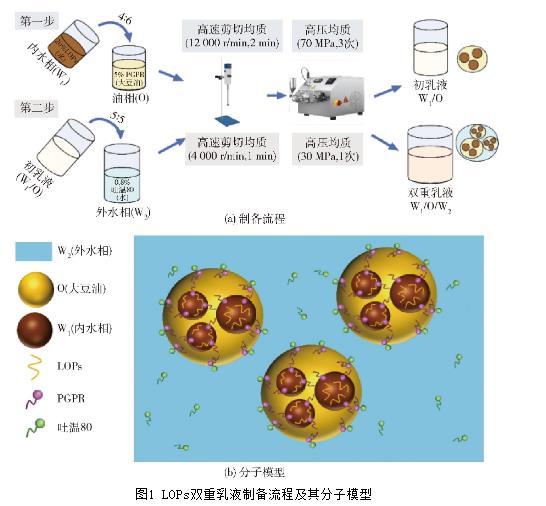
圖1 LOPs雙重乳液制備流程及其分子模型
1.3.3.2體外模擬消化液的配制與消化實驗
模擬消化液是由相應的電解質溶液、酶、CaCl2和膽酸鹽組成。按表1配制各階段的模擬消化液,其中,采用NaOH、HCl調節模擬消化液的pH值(模擬唾液的pH值為7、模擬胃液的pH值為3和模擬腸液的pH值為7),CaCl2(H2O)2可在酸環境下形成CaCl2。將模擬消化液與新鮮乳液、上一階段消化后的乳液以體積比1∶1混合,于37℃,120 r/min的條件下進行模擬消化,模擬口腔消化時長5 min,模擬胃消化和腸道消化時長均為2 h。取各階段消化產物與新鮮未消化乳液用于分析測定,比較模擬消化前后乳液的粒徑、包封率與顯微結構的變化情況。
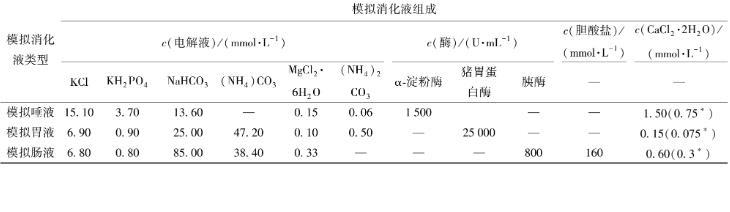
表1模擬消化液的配制
括號中帶*數字為最終消化混合物中相應的Ca2+濃度。
1.3.3.3粒徑測定
采用馬爾文納米粒度儀,室溫條件下測定乳液粒徑,于折射率為1.33,光散射角度為173°條件下,測定乳液的平均粒徑、多分散指數(polydispersity index,PDI)和粒徑分布。
1.3.3.4光學顯微鏡觀察
取樣品約5μL滴加于載玻片上,使用光學顯微鏡于100倍油鏡物鏡視野下進行觀察,利用系統攝像機記錄微觀形態照片。
1.3.3.5包封率測定
取6 g待測樣品與去離子水以質量比1∶1稀釋,輕輕手搖混勻,然后在3 000 r/min、4℃條件下離心10 min。利用注射器針頭收集每個離心樣品的水層(乳液的下層),并使用0.22μm注射器式過濾器過濾油滴后取得濾液。采用BCA蛋白質試劑盒制作LOPs的標準曲線,測定濾液中LOPs的含量,標準曲線方程為:y=0.014 2x+0.166 2(R2=0.979)。包封率(EE)計算公式見式(1)。
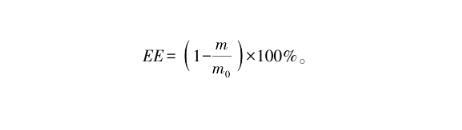 (1)
(1)
式(1)中,EE為包封率,%;m0為LOPs加入內水相的質量,g;m為從外水相中獲得的游離LOPs的質量,g。
1.3.4 LOPs及其雙重乳液的體外模擬吸收與轉運實驗
1.3.4.1 LOPs及其雙重乳液對Caco-2細胞的毒性實驗
選取生長對數期的Caco-2細胞,將其接種在96孔酶標板(1×105個/孔)并置于培養箱培養(含體積分數為5%的CO2、溫度設為37℃)約24 h后,加入100μL不同濃度(基礎培養基稀釋)的LOPs水溶液及其雙重乳液(稀釋前沸水浴加熱30 min滅菌,乳液未破乳),每個濃度設置6個平行,于含有體積分數為5%的CO2、溫度為37℃的培養箱中培養24 h后,向每孔加入體積為20μL的MTT溶液(5 mg/mL)和80μL基礎培養基,繼續溫育4 h后,除去孔內培養液并向每孔加入150μL的DMSO,將培養板置于搖床上低速振蕩10 min。用酶標儀測定酶標板各孔在490 nm的吸光度。實驗中同時設立正常細胞對照孔(無樣品,有Caco-2細胞、培養液、MTT和DMSO)以及空白對照孔(無樣品,無Caco-2細胞,有培養基、MTT和DMSO)。根據測定的吸光度計算Caco-2細胞的存活率,計算方法見式(2)。
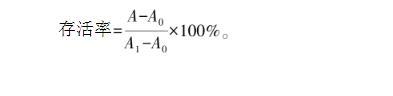
式(2)中,A為樣品吸光度,A0為空白對照組吸光度,A1為正常細胞培養的對照組吸光度。
1.3.4.2 Caco-2單層細胞模型的建立與驗證
構建3個初始細胞密度分別3×105、5×105、10×105個/mL的Caco-2單層細胞模型,用Transwell培養皿接種Caco-2細胞,細胞接種模型見圖2。細胞生長狀態維持21 d左右,前7 d每兩天更換膜兩側培養基,后14 d每天定時更換膜兩側培養基,直到Caco-2細胞完全融合形成完整的單層。通過測定跨膜電阻、堿性磷酸酶(AKP)活性和熒光素鈉通量比較和驗證單層Caco-2細胞模型的完整性、分化狀況和致密性。
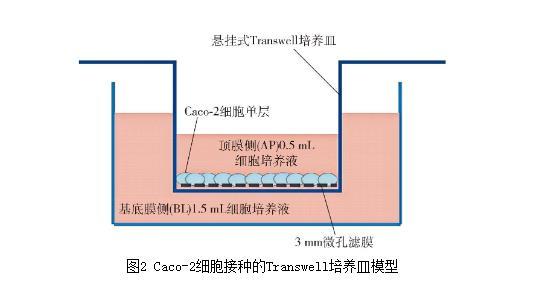
圖2 Caco-2細胞接種的Transwell培養皿模型
1)跨膜電阻的測定。采用電阻儀測定并記錄細胞膜兩側的跨膜電阻(trans-epithelial electrical resis-tance,TEER),根據式(3)計算TEER。
TEER=(R-R0)×S。(3)
式(3)中,TEER為跨膜電阻,Ω·cm2;R為頂膜側(AP)的電阻,Ω;R0為基底膜側(BL)的電阻,Ω;S為膜面積(1.12 cm2)。
2)AKP活性測定。采用AKP試劑盒分別測定AP側、BL側的堿性磷酸酶活性,酶活性單位為金氏單位/100 mL(一個金氏單位=7.14 U/L),并計算膜兩側的酶活力比值(AP/BL)。
3)熒光素鈉通量測定。制作490 nm處熒光素鈉的標準吸收曲線;采用培養21 d后的Transwell培養皿,于AP側加入0.5 mL、20μg/mL熒光素鈉溶液(D-hanks平衡液溶解),BL側加入1.5 mL的D-hanks平衡液,每間隔30 min測定BL側在490 nm處的吸收度,并補充BL側平衡液體積至1.5 mL,共計培養2 h。根據式(4)計算熒光素鈉透過率。
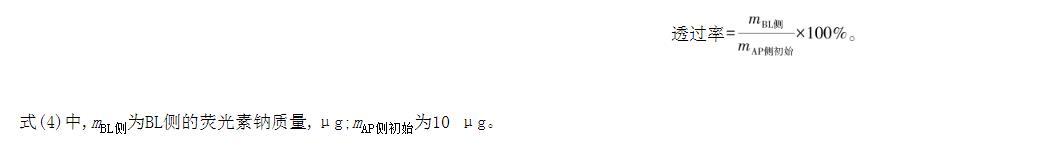
式(4)中,mBL側為BL側的熒光素鈉質量,μg;mAP側初始為10μg。
1.3.4.3 Caco-2單層細胞轉運實驗
根據1.3.3.2中的實驗結果,選取合格的細胞模型,測定LOPs溶液、LOPs雙重乳液(依據毒性實驗結果選取)在膜兩側的表觀滲透系數和流出比(表觀滲透系數比值),探究兩者的運輸方式。運輸實驗在兩個方向上進行。AP側→BL側:AP側加入0.5 mL樣品液,BL側加入1.5 mL D-hanks的平衡液。BL側→AP側:在BL側加入1.5 mL樣品液,AP側加入0.5 mL D-hanks平衡液。分別孵育150 min后收集BL側、AP側溶液待測。采用BCA蛋白測定法測定待測液中LOPs含量。根據樣品在兩個方向上的檢測結果計算表觀滲透系數Papp(AP-BL)、Papp(BL-AP)及兩個方向上的表觀滲透系數比值Papp(BL-AP)/Papp(AP-BL),計算方法見式(5)。

式(5)中,Q為AP側或BL側檢測到的轉運量;t為實驗轉運時間(150 min);S為膜面積(1.12 cm2);c0為BL側或AP側樣品的初始濃度。
1.4數據處理
實驗數據以平均值±標準差表示,用OrginPro2024軟件繪圖。用SPSS 26.0軟件采用方差分析進行差異顯著性分析,P<0.05表示差異顯著。










